Materiales y equipos
- Frascos de vidrio ámbar
- Bolsas papel o frascos de plástico
- Tamiz 2 mm
- Frascos de vidrio con tapón 100 ml
- Embudo de decantación 100 ml
- Viales de vidrio de 100 ml
- Viales de HPLC 2 ml
- Agitador orbital
- Centrífuga
- Tubos vidrio centrífuga 20 ml
- Diclorometano
- Acetona
- Acetonitrilo
- Agua destilada
- Filtros 0,22 μm
- MgSO4
Toma de muestras y almacenamiento
Distinguimos entre muestras que proceden de experimentos realizados en laboratorio, de muestras ambientales. Las muestras procedentes de experimentos realizados en laboratorio no requieren ningún tipo de tratamiento especial de almacenamiento previo al análisis si se realiza en el momento. Si pasa tiempo hasta su análisis al igual que las muestras ambientales deberán ser almacenadas refrigeradas hasta su posterior análisis.
Así mismo, se distinguen dos protocolos para muestras acuosas y muestras de suelos o sedimentos. Las muestras ambientales de agua serán recogidas en frascos de vidrio ámbar (500 ml) y almacenadas en refrigeración hasta su análisis. Las muestras ambientales de suelos o sedimentos serán recogidas en frascos o bolsas de papel (dependiendo de su grado de humedad y contenido en agua) y almacenadas en refrigeración. Antes de analizar, los suelos o sedimentos deberán ser secados a Tª ambiente (evitar Tª elevadas que favorezcan la volatilización de PAHs). Cuando estén completamente secos se tamizarán los suelos con un tamiz de 2mm (permite el paso arcillas, limos y arenas que son la fracción en la cual los PAHs pueden quedar retenidos en los poros) y se guardarán de nuevo en frascos hasta iniciar el proceso de extracción.
Extracción de las muestras
Muestras acuosas
Para extraer PAHs de muestras acuosas se trabajará con una mezcla de n-hexano:acetona (1:1 v/v) como solución extractante (Jørgensen et al., 2005; Rocchetti et al., 2011). Según indican algunos autores (Simarro et al., 2013), se puede utilizar únicamente diclorometano como solución extractante. Sin embargo, la mezcla de n-hexano (no polar) y acetona (polar) asegura la extracción de todos los PAHs en el solvente no polar mientras que la acetona retira todos los compuestos polares que podrían interferir en los procesos de cromatografía y análisis (Jørgensen et al., 2005).
Para proceder con la extracción se tomarán 40 ml de muestra acuosa y se lavarán con 20 ml en total de solución extractante. Poner la muestra acuosa en un frasco de vidrio con tapón para evitar la volatilización de la solución extractante y añadir 5ml de la misma.
- Agitar la mezcla en un agitador orbital durante 15-20 min a 150 rpm. Introducir la mezcla en un embudo de decantación de 100 ml y mezclar manualmente mediante movimientos suaves del embudo para evitar que se forme una emulsión. Dejar que la fase acuosa (medio acuoso + acetona miscible en agua) y la fase orgánica (n-hexano y PAHs extraídos) se separen. Recoger en un vial de vidrio de más de 20 ml la fase orgánica. Repetir esta operación 3 veces lavando la fase acuosa hasta completar los 20 ml totales de solución extractante.
- Una vez finalizados los lavados, dejar evaporar por completo el n-hexano del vial de vidrio. En caso de que cierta cantidad de fase acuosa se hubiera recogido en el vial, se puede retirar mediante la adición de una pequeña cantidad de MgSO4 sin hidratar que actuará como agente secante.
- Una vez evaporado por completo el n-hexano, resuspender el precipitado (PAHs extraídos) en 2 ml de acetonitrilo (calidad HPLC) y dejar en el vial durante 5 min agitando manualmente cada poco tiempo para permitir la completa disolución de los PAHs. Posteriormente, recoger los 2ml de muestra y traspasar a un vial de HPLC, filtrando la muestra previamente con ayuda de una jeringa de 1ml y un filtro de 0,22 μm. Precintar el vial y reservar en refrigeración hasta su posterior análisis en el UHPLC.
Cuando se trate de muestras ambientales en las que se espere una muy baja concentración de PAHs, se puede proceder filtrando 1000 ml de muestra. Posteriormente, extraer los PAHs del filtro lavando el filtro con n-hexano y continuar en el apartado 2 del protocolo anterior.
Muestras de suelos o sedimentos
Para extraer PAHs de muestras de suelos o sedimentos se trabajará con una mezcla de n-hexano:acetona (1:1 v/v) como solución extractante (Jørgensen et al., 2005; Rocchetti et al., 2011). De acuerdo con algunos autores, la extracción puede realizarse únicamente con diclorometano (Simarro et al., 2013).
- Para proceder con la extracción, el suelo se lavará con 60 ml en total de solución extractante. Pesar 10 g de suelo, disponer en un frasco de vidrio con tapón y añadir 20 ml de solución extractante.
- Agitar la mezcla en un agitador orbital durante 15-20 min a 150 rpm. Introducir los frascos en un baño de ultrasonidos y sonicar durante 10 minutos. La potencia de la sonicación dependerá de la tendencia que muestre la muestra a calentarse. Si la muestra se calienta mucho, disminuir la potencia. Si la muestra soporta bien el proceso, se puede aumentar el tiempo de sonicación hasta 30 min.
- Decantar el solvente en un tubo de vidrio para centrifugar la muestra a 5000 rpm durante 5 o 10 min para separar posibles restos de sedimentos en la fase orgánica. El tiempo de centrifugación puede ser de 5 o 10 min en función de cómo se separen los sedimentos. Comprobar que el solvente queda libre de sedimentos.
- Introducir la solución extractante (20 ml aporx.) en un embudo de decantación de 100 ml y añadir 30 ml de agua destilada para retirar la parte de acetona que contiene la solución extractante. Mezclar manualmente mediante suaves movimientos del embudo para evitar que emulsione. Dejar que se separen la fase orgánica (n-hexano y PAHs) y la fase acuosa (agua destilada + acetona). Descartar la fase acuosa y recoger la fase orgánica en un vial de vidrio de más de 60 ml. Repetir esta operación 2 veces más con los sedimentos hasta completar los 60 ml totales de solución extractante.
- Una vez finalizados los lavados, dejar evaporar por completo el n-hexano del vial de vidrio. En caso de que cierta cantidad de fase acuosa se hubiera recogido en el vial, se puede retirar mediante la adición de una pequeña cantidad de MgSO4 sin hidratar que actuará como agente secante.
- Una vez evaporado por completo el n-hexano, resuspender el precipitado (PAHs extraídos) en 2 ml de acetonitrilo (calidad HPLC) y dejar en el vial durante 5 min agitando manualmente cada poco tiempo para permitir la completa disolución de los PAHs. Posteriormente, recoger los 2ml de muestra y traspasar a un vial de HPLC, filtrando la muestra previamente con ayuda de una jeringa de 1ml y un filtro de 0,22 μm.
De acuerdo con la bibliografía existente (Simarro et al., 2013) el proceso de extracción se puede realizar mediante un dispositivo Soxhlet. Para ello, 10 g de suelo se extraen durante un periodo de 3 h con 100 ml de la solución extractante en cuestión en un dispositivo Soxhlet. Posteriormente el solvente es evaporado en un rotavapor y el residuo se resuspende en 2ml de acetonitrilo y se procede tal y como se explica en el apartado 6.
Cromatografía
En el presente protocolo se utiliza el método descrito por Molina et al. (2008), optimizado para un UHPLC de Shimadzu.
Condiciones:
Fase A- acetonitrilo
Fase B- agua destilada
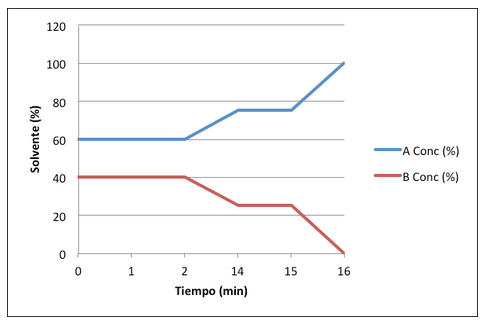
| Time (min.) | Programa de gradiente móvil | (%) | (%) |
|---|---|---|---|
| Isocrático (2 min) | |||
| Gradiente de: | |||
| Isocrático (1 min) | |||
| Gradiente de: |
Volumen de inyección: 10 μl
Flujo: 0,8 ml/min
Tª: 25 ºC
Tipo de columna: Luna C18(2). 7,5 cm longitud x 4,6 mm diámetro interno. Tamaño de partícula 3 μm.
REFERENCIAS BILIOGRÁFICAS
Jørgensen K.S., Järvinen O., Sainio P., Salminen J, Suortti A-M “Quantification of soil contamination”, en Manual of soil analysis, (Eds) Margesin & Schinner 2005. Vol (3); Cap.3; p. 109-115. Springer (Alemania).
Rocchetti L., Beolchi F., Ciani B., Dell´Anno A. (2011) Improvement of bioremediation performance for degradation of petroleum hydrocarbons in contaminated sediments. Applied of Environmental Soil Science. DOI: 10.1155/2011/319657.
Simarro R., González N., Molina M.C., Bautista L.F. (2013) High molecular weight PAH biodegradation by a wood degrading bacterial consortium at low temperatures. FEMS Microbial Ecology. vol 83: p. 438-449.
